ఫారడే యొక్క విద్యుద్విశ్లేషణ నియమాలు
ఫారడే యొక్క విద్యుద్విశ్లేషణ నియమాలు మైఖేల్ ఫెరడే యొక్క ఎలెక్ట్రోకెమికల్ పరిశోధన ఆధారంగా పరిమాణాత్మక సంబంధాలు, దీనిని అతను 1836లో ప్రచురించాడు.
ఈ చట్టాలు విడుదలైన పదార్ధాల మొత్తం మధ్య సంబంధాన్ని నిర్ణయిస్తాయి విద్యుద్విశ్లేషణ సమయంలో మరియు ఎలక్ట్రోలైట్ గుండా విద్యుత్ మొత్తం. ఫెరడే చట్టాలు రెండు. శాస్త్రీయ సాహిత్యంలో మరియు పాఠ్యపుస్తకాలలో, ఈ చట్టాల యొక్క వివిధ సూత్రీకరణలు ఉన్నాయి.
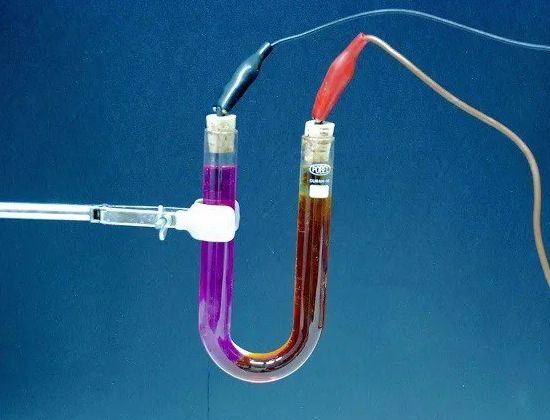
విద్యుద్విశ్లేషణ - గడిచే సమయంలో దానిలోని పదార్ధాల ఎలక్ట్రోలైట్ నుండి విడుదల విద్యుత్… ఉదాహరణకు, ఒక విద్యుత్ ప్రవాహం కొద్దిగా ఆమ్లీకృత నీటి గుండా వెళుతున్నప్పుడు, నీరు దాని భాగాలుగా కుళ్ళిపోతుంది - వాయువులు (ఆక్సిజన్ మరియు హైడ్రోజన్).
ఎలక్ట్రోలైట్ నుండి విడుదలయ్యే పదార్ధం మొత్తం ఎలక్ట్రోలైట్ గుండా వెళుతున్న విద్యుత్ మొత్తానికి అనులోమానుపాతంలో ఉంటుంది, అంటే, ఈ కరెంట్ ప్రవహించే సమయాల బలం యొక్క ఉత్పత్తి. అందువల్ల, విద్యుద్విశ్లేషణ యొక్క దృగ్విషయం ప్రస్తుత బలాన్ని కొలవడానికి మరియు నిర్ణయించడానికి ఉపయోగపడుతుంది ప్రస్తుత యూనిట్లు.
ఎలక్ట్రోలైట్ - ఒక పరిష్కారం మరియు సాధారణంగా విద్యుత్ ప్రవాహాన్ని నిర్వహించే సంక్లిష్ట ద్రవం.బ్యాటరీలలో, ఎలక్ట్రోలైట్ అనేది సల్ఫ్యూరిక్ ఆమ్లం (సీసంలో) లేదా కాస్టిక్ పొటాష్ లేదా కాస్టిక్ సోడా (ఐరన్-నికెల్లో) యొక్క పరిష్కారం. గాల్వానిక్ కణాలలో, ఏదైనా రసాయన సమ్మేళనాల (అమ్మోనియా, కాపర్ సల్ఫేట్ మొదలైనవి) యొక్క పరిష్కారాలు కూడా ఎలక్ట్రోలైట్గా పనిచేస్తాయి.
మైఖేల్ ఫెరడే (1791 - 1867)
మైఖేల్ ఫెరడే (1791 - 1867) - ఆంగ్ల భౌతిక శాస్త్రవేత్త, విద్యుదయస్కాంత దృగ్విషయం యొక్క ఆధునిక సిద్ధాంత స్థాపకుడు. అతను బుక్బైండింగ్ వర్క్షాప్లో అప్రెంటిస్గా తన ఉద్యోగ జీవితాన్ని ప్రారంభించాడు. అతను ప్రాథమిక విద్యను మాత్రమే పొందాడు, కానీ స్వతంత్రంగా సైన్స్ చదివాడు మరియు రసాయన శాస్త్రవేత్త దేవికి ప్రయోగశాల సహాయకుడిగా పనిచేశాడు, అతను గొప్ప శాస్త్రవేత్త అయ్యాడు, గొప్ప ప్రయోగాత్మక భౌతిక శాస్త్రవేత్తలలో ఒకడు.
ఫారడే తెరిచాడు విద్యుదయస్కాంత ప్రేరణ యొక్క దృగ్విషయం, విద్యుద్విశ్లేషణ నియమాలు, విద్యుత్ మరియు అయస్కాంత క్షేత్రాల సిద్ధాంతాన్ని అభివృద్ధి చేసి, రూపొందించబడ్డాయి ఆధునిక విద్యుదయస్కాంత క్షేత్ర భావనల పునాదులు… విద్యుదయస్కాంత దృగ్విషయం యొక్క కంపన, తరంగ స్వభావం యొక్క ఆలోచనను కలిగి ఉన్న మొదటి శాస్త్రవేత్త.
విద్యుద్విశ్లేషణ యొక్క ఫెరడే యొక్క మొదటి నియమం
విద్యుద్విశ్లేషణ సమయంలో ఎలక్ట్రోడ్పై అవక్షేపించే పదార్ధం యొక్క ద్రవ్యరాశి ఆ ఎలక్ట్రోడ్కు బదిలీ చేయబడిన విద్యుత్ మొత్తానికి నేరుగా అనులోమానుపాతంలో ఉంటుంది (ఎలక్ట్రోలైట్ గుండా వెళుతుంది). విద్యుత్ మొత్తం అనేది విద్యుత్ ఛార్జ్ మొత్తాన్ని సూచిస్తుంది, సాధారణంగా పెండెంట్లలో కొలుస్తారు.
విద్యుద్విశ్లేషణ యొక్క ఫెరడే యొక్క రెండవ నియమం
ఇచ్చిన మొత్తంలో విద్యుత్ (విద్యుత్ ఛార్జ్), విద్యుద్విశ్లేషణ సమయంలో ఎలక్ట్రోడ్పై నిక్షిప్తం చేయబడే రసాయన మూలకం యొక్క ద్రవ్యరాశి ఆ మూలకం యొక్క సమాన ద్రవ్యరాశికి నేరుగా అనులోమానుపాతంలో ఉంటుంది. పదార్ధం యొక్క సమాన ద్రవ్యరాశి దాని మోలార్ ద్రవ్యరాశిని మొత్తం సంఖ్యతో భాగించబడుతుంది, ఇది పదార్ధం పాల్గొన్న రసాయన ప్రతిచర్యపై ఆధారపడి ఉంటుంది.
లేదా
అదే మొత్తంలో విద్యుత్తు విద్యుద్విశ్లేషణ సమయంలో ఎలక్ట్రోడ్లపై వివిధ పదార్ధాల సమానమైన ద్రవ్యరాశిని విడుదల చేయడానికి దారితీస్తుంది. ఏదైనా పదార్ధానికి సమానమైన ఒక మోల్ను విడుదల చేయడానికి, అదే మొత్తంలో విద్యుత్తును ఖర్చు చేయడం అవసరం, అంటే 96485 C. ఈ ఎలక్ట్రోకెమికల్ స్థిరాంకం అంటారు. ఫెరడే సంఖ్య.
గణిత రూపంలో ఫెరడే చట్టాలు
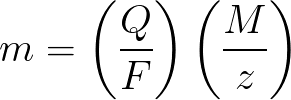
-
m అనేది ఎలక్ట్రోడ్పై నిక్షిప్తం చేయబడిన పదార్ధం యొక్క ద్రవ్యరాశి;
-
Q అనేది విద్యుద్విశ్లేషణ సమయంలో ఆమోదించబడిన పెండెంట్లలోని మొత్తం విద్యుత్ ఛార్జ్ యొక్క విలువ;
-
F = 96485.33 (83) C / mol — ఫెరడే సంఖ్య;
-
M అనేది g/molలో మూలకం యొక్క మోలార్ ద్రవ్యరాశి;
-
z - ఒక పదార్ధం యొక్క అయాన్ల విలువ సంఖ్య (అయాన్కు ఎలక్ట్రాన్లు);
-
M / z - ఎలక్ట్రోడ్కు వర్తించే పదార్ధం యొక్క సమానమైన ద్రవ్యరాశి.
ఫెరడే యొక్క విద్యుద్విశ్లేషణ యొక్క మొదటి నియమానికి వర్తించబడుతుంది, M, F మరియు z స్థిరాంకాలు, కాబట్టి ఎక్కువ Q, ఎక్కువ m ఉంటుంది.
ఫెరడే యొక్క విద్యుద్విశ్లేషణ యొక్క రెండవ నియమం ప్రకారం, Q, F మరియు z స్థిరాంకాలు, కాబట్టి ఎక్కువ M / z, ఎక్కువ m ఉంటుంది.
డైరెక్ట్ కరెంట్ కోసం మేము కలిగి ఉన్నాము
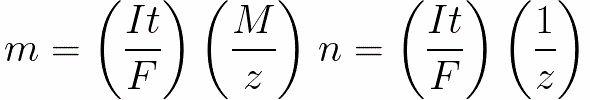
-
n అనేది ఎలక్ట్రోడ్పై విడుదలయ్యే మోల్స్ (పదార్థం మొత్తం) సంఖ్య: n = m / M.
-
t అనేది ఎలక్ట్రోలైట్ ద్వారా డైరెక్ట్ కరెంట్ గడిచే సమయం. ఆల్టర్నేటింగ్ కరెంట్ కోసం, మొత్తం ఛార్జ్ కాలక్రమేణా సంగ్రహించబడుతుంది.
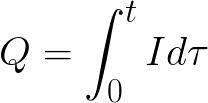
-
t అనేది మొత్తం విద్యుద్విశ్లేషణ సమయం.
ఫెరడే చట్టాలను వర్తింపజేయడానికి ఒక ఉదాహరణ
జడ యానోడ్తో సోడియం సల్ఫేట్ యొక్క సజల ద్రావణం యొక్క విద్యుద్విశ్లేషణ సమయంలో కాథోడ్ మరియు యానోడ్ వద్ద ఎలెక్ట్రోకెమికల్ ప్రక్రియల సమీకరణాన్ని వ్రాయడం అవసరం. సమస్యకు పరిష్కారం క్రింది విధంగా ఉంటుంది. ద్రావణంలో, సోడియం సల్ఫేట్ క్రింది పథకం ప్రకారం విడదీయబడుతుంది:
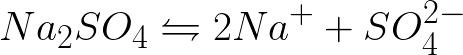
ఈ వ్యవస్థలో ప్రామాణిక ఎలక్ట్రోడ్ సంభావ్యత క్రింది విధంగా ఉంది:
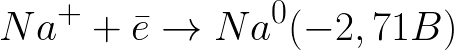
తటస్థ మాధ్యమంలో (-0.41 V) హైడ్రోజన్ ఎలక్ట్రోడ్ కంటే ఇది చాలా ప్రతికూల సంభావ్య స్థాయి. అందువల్ల, ప్రతికూల ఎలక్ట్రోడ్ (కాథోడ్) పై, కింది పథకం ప్రకారం హైడ్రోజన్ మరియు హైడ్రాక్సైడ్ అయాన్ విడుదలతో నీటి ఎలెక్ట్రోకెమికల్ డిస్సోసియేషన్ ప్రారంభమవుతుంది:
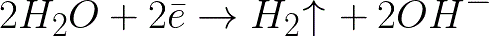
మరియు ధనాత్మకంగా చార్జ్ చేయబడిన సోడియం అయాన్లు ప్రతికూలంగా చార్జ్ చేయబడిన కాథోడ్కు చేరుకుంటాయి, కాథోడ్ దగ్గర, ద్రావణం యొక్క ప్రక్కన ఉన్న భాగంలో పేరుకుపోతాయి.
సానుకూల ఎలక్ట్రోడ్ (యానోడ్) పై నీటి ఎలెక్ట్రోకెమికల్ ఆక్సీకరణ జరుగుతుంది, ఇది క్రింది పథకం ప్రకారం ఆక్సిజన్ విడుదలకు దారి తీస్తుంది:
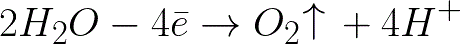
ఈ వ్యవస్థలో, ప్రామాణిక ఎలక్ట్రోడ్ సంభావ్యత +1.23 V, ఇది కింది సిస్టమ్లో కనిపించే ప్రామాణిక ఎలక్ట్రోడ్ పొటెన్షియల్ కంటే చాలా తక్కువగా ఉంటుంది:
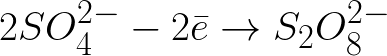
ధనాత్మకంగా చార్జ్ చేయబడిన యానోడ్ వైపు కదులుతున్న ప్రతికూలంగా చార్జ్ చేయబడిన సల్ఫేట్ అయాన్లు యానోడ్ సమీపంలోని ప్రదేశంలో పేరుకుపోతాయి.

